Farmaatsiatoodete tootmisel on hinnanguliselt 2–3σ (sigma) ebatäpsuse tase. See vastab 66 807 kuni 308 537 defektile 1 000 000 võimaluse kohta. Kuid kuna ravimiarendus on nii keeruline, võib eksida rohkem kui 1 000 000 „võimalust“.
Eespool loetletud veaarvutusele viidati väikese molekuliga farmakoloogias. Kuid üha keerukamatel ravimitel (näiteks tänapäeval laialdaselt kasutatavatel biotehnoloogilistel toodetel, sealhulgas GLP-1 diabeedi / kehakaalu langetamise või modRNA toodetel) on molekulmass, mis võib olla tuhandeid kordi suurem kui väikestel molekuliühenditel. See võib tähendada veelgi suuremat eksimisvõimalust.
USA Toidu- ja Ravimiamet (Food and Drug Administration, FDA) on teadlik ravimite võimalikest kvaliteedipuudustest.
FDA farmaatsiakvaliteedi büroo (Office of Pharmaceutical Quality, OPQ) praegune direktor dr Michael Kopcha avaldas ülaltoodud avaldatud Six Sigma arvutuse, kurtes farmaatsiatootmise ebatäpse olemuse üle juba 2017. aastal.
Mis tahes struktuuri muutus, mis toimub tootmise ajal, võib oluliselt muuta ühendi kliinilist aktiivsust, sealhulgas muutuda terapeutilisest ravimist mürgiks.
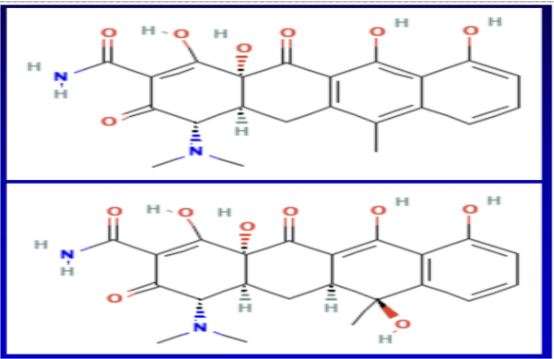
Slaid näitab tetratsükliini ja epianhüdrotetratsükliini keemiapulga struktuure. Üks neist on üldiselt ohutu antibiootikum, teine mürk, mis põhjustab neerupuudulikkust juba kahe päeva jooksul. Isegi väga väikesed struktuurimuutused võivad kujutada erinevust mürgi ja terapeutilise ravimi vahel.
Näiteks eespool kirjeldatud tetratsükliini molekulmass on ligikaudu 445 g/mol. Covidi modRNA viaaliannustel on hinnanguliselt 3000 korda suuremad kui tetratsükliin, välja arvatud olulised, mitmekesised ja kliiniliselt keerulised lipiidide nanoosakesed.
Suuremad struktuurid tähendavad suuremat veapotentsiaali. modRNA toote kvaliteedikontrolli kõrvalekalded võivad väidetavalt olla põhjuseks, miks sajad tuhanded surid või on Covidi süstide tagajärjel raskelt haigestunud, samas kui teistel on teatatud väiksematest või üldse mitte esinevatest kõrvaltoimetest. See on eriti kriitiline küsimus, sest lisaks sellele, et segati neid tooteid arendamise, autoriseerimise, heakskiitmise ja tootmise kaudu „lõimekiirusel“. Lõpuks ei avalda tootjad ega FDA Covidi modRNA “vaktsiinide“ täpset struktuuri ega koostisosi, mis tähendab, et avalikkus on pime ja 100% sõltub FDA-st, et iseseisvalt koguda ja testida süste kvaliteedikontrolliks.
Hiina ja India ravimitootjate ohjeldamatu pettus lisaks halvale kvaliteedile:
Hiina ja India on koht, kust tuleb valdav osa geneeriliste ravimite pakkumisest. Mõlemal riigil on nii ajalooline kui ka hiljutine halva kvaliteedikontrolli ajalugu, lisaks kohutavatele ravimipettuste juhtumitele.
Näiteks Indias asuvale (nüüdseks kadunud) geneeriliste ravimite tootmisettevõttele Ranbaxyle määrati 500 miljoni dollari suurune trahv selle eest, et ta valetas FDA-le korduvalt ravimite kvaliteedi ja järjepidevuse testimise kohta. Üldiselt võib öelda, et Hiinast ja Indiast pärit ravimite tarnimisel on pettuste ja andmete võltsimise ajalugu kümme aastat, mis langeb kokku ajaga, mil ravimitootjad hakkasid sinna ümber asuma.
FDA kontrolliaruanded kirjeldavad üksikasjalikult märkimisväärset põlgust tootmise, kvaliteedi, arvestuse pidamise ja isegi puhtuse põhistandardite kõige elementaarsemate regulatiivsete standardite suhtes.
Mittetäielik järelevalve tähendab halva kvaliteediga ravimeid haiglates ja apteekides:
FDA ametlike dokumentide ja väljaannete kohaselt ei kogu ega testi FDA iseseisvalt >99.9%, sealhulgas Hiinast ja Indiast pärit ravimitest.
2021, 2022 ja 2023 FDA OPQ testimine:
- Nende veebisaidi andmetel kogus FDA OPQ kogu 2021. aasta jooksul ainult iseseisvalt ja viis läbi kvaliteedikontrolli 137 (ainulaadse) ravimi üle. 137-st valitud tootest 73 (53%) olid „käte desinfitseerimisvahendid“. Ainult viis erinevat toimeainet, mille OPQ testimiseks valis, olid 100 parimat retseptiravimit.
- Kogu 2022. aasta jooksul testis FDA OPQ 376 ainulaadset toodet. 278 neist toodetest 376-st (74%) olid „käte desinfitseerimisvahendid“. Ükski testitud toimeainetest ei olnud USA-s 100 parimat retseptiravimit.
- Kogu 2023. aasta jooksul testis FDA OPQ 79 (ainulaadset) toodet. Ainult kolm erinevat toimeainet olid 100 enim väljakirjutatavate retseptiravimite hulgas.
- Praegu pole teavet millegi kohta, mida FDA 2024. aastal testis.
Kümnetest tuhandetest farmaatsiatoodetest, mida FDA reguleerib, otsustasid 2021., 2022. ja 2023. aastaks peaaegu eranditult läbi viia kvaliteedikontrolli käte desinfitseerimisvahenditega.
„Käte desinfitseerimisvahendite“ ja / või varjatud esemete ebaproportsionaalne testimine kui mõned väga vähestest toodetest, mida FDA iseseisvalt kogus ja testis, pole 2022. aastaks midagi uut. Nagu lingitud arvutustabelitest näha, tegi FDA sama ka 2020. ja 2021. aastal.
Samal ajal jättis FDA suures osas välja suuremahulised ravimid, rääkimata Covidi modRNA süstidest, hoolimata sellest, et neid toodetakse „lõimekiirusel“. Tänapäeval seostatakse neid süste enam kui miljoni siseriikliku kõrvaltoimega, mis võivad olla otseselt seotud ravimi kvaliteedi- ja toote järjepidevuse kõrvalekalletega.
Kriitilised teemad ja küsimused ravimi- ja farmaatsiatoodete testimise kohta on järgmised:
- Kes või milline FDA personal või teaduslik metoodika tegi kindlaks, et pelgalt ~ 0.001% ravimite sõltumatu kogumine ja testimine on kõigi 150 000 toote asjakohane esitus, mida OPQ jälgib? OPQ kvaliteedikontrolli andmete avaldamise edasilükkamine umbes aasta (st 2023. aasta andmed avaldati alles 2024. aasta märtsi paiku ja ühtegi 2024. aasta OPQ leidu ei jagatud isegi oktoobri lõpus).
- OPQ andmetes minimaalselt avaldatud teave „Tehtud testide“ kohta loetles ainult selliseid asju nagu „Friability / tableti kõvadus“ ja „lahustumine“ ning „alumiinium“ ja „visuaalne uurimine …“. Kas OPQ ei teinud põhjalikke ravimite vabastamise teste, et kontrollida selliseid asju nagu milligrammi täpsus või bakteriaalne- ja mikroobne saastumine? Miks mitte viia läbi täielik testimine ja jagada täielikke tulemusi?
- „Tulemused“ sisaldasid ainult väga lihtsustatud ja ebamääraseid selgitusi, nagu „Läbitud (testid)“ või „Ebaõnnestunud (testid)“ või „Ebaõnnestunud lisandid“, mis ei andnud konkreetset teavet protsentuaalse puhtuse, partiide arvu, tarbijateni jõudvate partiiühikute, kasutatud metoodika, kasutatud instrumentide, kalibreerimise või lubatud hälvete kohta. Lisaks ei olnud sellel täpselt nimetatud, millised olid konkreetsed lisandid või lisandi aste (nt kas lisand 1 osa 1000 kohta vs. 1:100 000 vs. 1:1 000 000 vs. 1:1 000 000 000?).
- Tüüpilised analüüsid pakuvad põhjalikke kvantitatiivseid ja kvalitatiivseid ning muid analüütilisi leide ja / või peaksid sisaldama täielikku selgitust võimalike tagajärgede kohta sellele, mida ebaõnnestunud test võib kliiniliselt tähendada – eriti seetõttu, et seda viib läbi FDA – ja eriti kui neid tooteid antakse juba haigetele ja / või haiglates patsientidele.
Teine oluline OPQ ebaõnnestumine hõlmas üksikasjalike järelkontrolli juhiste puudumist, mida patsiendid saaksid järgida, kui neil õnnestus kuidagi avastada, et nad on võtnud halva kvaliteediga toote. Nende hulka kuuluvad:
- Mida peaksid patsiendid tegema? Kas patsiendid peavad rääkima oma apteekri või arstiga? Millist teavet nad peavad neile ütlema? Kas kindlustused katavad need nõuded või peavad patsiendid maksma asendusravimite ja arstivisiitide eest oma taskust?
- Kas patsiendid peaksid kohe lõpetama oma ravimite võtmise, mis ei läbi FDA OPQ analüütilist testimist?
- Apteekrid ja arstid ei ole toksikoloogid. Miks ei paku FDA OPQ või meditsiiniametnikud ebaõnnestunud testitulemuste ja / või muude konkreetsete juhiste kõrval konkreetseid meditsiinilisi või laboratoorseid teste?
- Miks ei ole patsientidel / apteekritel / arstidel telefoni ega e-posti aadressi, et konkreetsete soovituste saamiseks FDA OPQ-ga ühendust võtta? Kas patsiendid/apteekrid/arstid peaksid selle ise välja mõtlema?
- Kas patsiendid peaksid pöörduma mürgistusteabekeskuse poole? Kas neil on piisavad teadmised, mida teha?
- Milliseid katseid FDA / tootjad tegid mõjutatud patsientidega ühenduse võtmiseks, et teavitada neid ebaõnnestunud testidest, kuna ebaõnnestunud kvaliteeditestide tulemusi ei postitata nende veebisaidile õigeaegselt?
- Kas oli olemas tootja või konkreetne töötaja karistus või muu vastutus spetsifikatsioonist väljas olevate toodete eest? Kui ei, siis miks mitte?
- Milline oli sündmuste kaskaad, mis viis ekslike järeldusteni ja milliseid põhimõtteid/protseduure FDA ja/või tootjad muutsid, et vältida sama vea (vigade) kordumist?
FDA veebilehtedel on komme mõne aja pärast “kaduda“. Aruande lingid on lisatud otse allalaadimise Exceli arvutustabelisse selle kohta, mida testiti ja milliseid tulemusi FDA pakkus.
FDA otsustab testida ebaproportsionaalselt tooteid, mis on valmistatud siseriiklikes üksustes. Näiteks 2021. aastal oli Arkansases Little Rockis asuv väikeettevõte Rock Town Distillery üks sadadest USA-s asuvatest tootjatest, kelle etanoolipõhist kätepuhastusvahendit analüüsis FDA OPQ kvaliteedi osas.
FDA keskendub väikeettevõtete tootjatele versus mitme miljardi dollari suurused tootjad, peamiselt „käte desinfitseerimisvahendite“ 150 000 tootest väikeettevõtted, mida FDA OPQ reguleerib.
Rock Town Distillery andis vabatahtlikult oma käte desinfitseerimisvahendid tasuta ära. Nad tegid seda vastusena kaitsetootmise seadusele.
Rock Town Distillery, mis on väikeettevõtte baar / piiritusetehas: teenib vähem kui 5 miljonit dollarit aastas ja sellel on vähem kui 10 töötajat. Võrrelge seda India farmaatsiaettevõttega Cipla, mille tulu on 3 miljardit dollarit aastas, turukapitalisatsioon üle 13,5 miljardi dollari ja üle 26 000 töötaja ning mis müüb umbes 1500 toodet 86 erinevas riigis.
Kuigi FDA kontrollis ja analüüsis sadu väikeettevõtteid, nagu Rock Town Distillery nende „käte desinfitseerimisvahendite“ osas, ei olnud leitavad farmakoloogi dr David Gortleri väitel mingeid tõendeid selle kohta, et OPQ või mõni muu FDA osakond kontrolliks või analüüsiks kvaliteedikontrolliks Pfizerit või Modernat või mõnda muud Covidi ravimitootjat nende väga keerukate „lõimekiirusega“ toodetud toodete kohta.
Kas FDA ebaproportsionaalne keskendumine siseriiklikele piiritusetehastele on näide FDA poliitilisest tagakiusamisest väikeettevõtete vastu? Vaadake lingitud iga-aastaseid arvutustabeleid / vahelehti kõige kohta, mida viimase nelja aasta jooksul testiti ja otsustage ise!
FDA ebaproportsionaalne keskendumine väikeettevõtetele näib illustreerivat, millest on saanud pikk nimekiri näidetest Wall Streeti kasvu plahvatuslikust kasvust, mis on ehitatud (väikeettevõtete) hävitamisele.
Tänaseks päevaks on üleriigiliselt avatud väikeettevõtteid 37.5% vähem kui 2020. aasta jaanuaris.

Pildil on vaid üks Cipla 47 tootmiskohast/tehasest kogu maailmas, kust ta müüb oma 1500 erinevat toodet 86 riiki, sealhulgas USA-sse. Cipla on Indias suuruselt kolmas ravimitootja. Cipla on noteeritud New Yorgi börsil, selle käive on 3 miljardit dollarit aastas, turukapital üle 13,5 miljardi dollari ja sellel on üle 26 000 töötaja.

AINUS USA-S VALMISTATUD 505-G FDA-REGULEERITUD TOODE, MILLE KVALITEETI AUDITEERIS FDA OPQ 2022. aastal: Rock Town Distillery toodab teravilja etanooli ainult piirkondlikust maisist, nisust ja rukkist. Ainus põhjus, miks ta valmistas käte desinfitseerimisvahendit, oli Ameerika Ühendriikide tervishoiu- ja inimteenuste osakonna (United States Department of Health and Human Services, HHS) kaitsetootmise seaduse III jaotise korralduste alusel toota olulisi meditsiinilisi vastumeetmeid ja kriitilisi sisendeid vastuseks rahvatervise kriisile.
Miks keskenduvad FDA OPQ direktorid dr Michael Kopcha ja / või dr Jennifer Maguire ebaproportsionaalselt väikeettevõtetele?
Dr Maguire postitab Twitteris töö kohta, mida ta teeb FDA-s nime all “@Quality_Sleuth“. Ilmselt toodi välja „käte desinfitseerimisvahendid“, sest „mõned“ vahendid olid 1-propanooli suhtes positiivsed, mis dr Maguire’i sõnul „… võib allaneelamisel olla mürgine ja eluohtlik“.
Väidetavalt, isegi kui täiuslikult valmistatud käte desinfitseerimisvahendeid tarvitatakse, võib eeldada, et need tekitavad ebasoovitavaid ja / või toksilisi mõjusid. Sellest hoolimata kontrolliti neid nii 2021. kui ka 2022. aastal väga ebaproportsionaalselt.
„Käte desinfitseerimisvahendite“ „suukaudse allaneelamise“ tajutava riski tõttu FDA OPQ direktor dr. Jennifer Maguire ja / või dr Michael Kopcha keskendusid oma osakonna jõupingutustele tugevalt käte desinfitseerimisvahendite testimisele, ületades ülejäänud 150 000 erinevat toodet, mida nende kontor reguleerib. Seda hoolimata asjaolust, et valdav enamus neist 150 000 valmisravimist on valmistatud Hiinas ja Indias, millel mõlemal on pikk ja väljakujunenud ajalugu kvaliteedikontrolli probleemidega.
PubChemi sõnul on 1-propanooli paiksed ohutus- ja toksilisusriskid sarnased etanooli, isopropüülalkoholi või bensalkooniumkloriidi omadega, millest igaüht kasutatakse eraldi käte desinfitseerimisvahendite peamiste aktiivsete antiseptiliste koostisosadena. Lisaks näitas FDA kõrvaltoimete andmebaasi (AERS) veebisaidilt 1-propanooli aruannete otsing ainult nelja aruannet 2020. aasta kuni uusima kättesaadava AERS-i andmebaasi kohta, mis FDA andmetel on „kontrollimata“ ja „ei ole lõplikud tõendid põhjusliku seose kohta tootega kokkupuute ja teatatud sündmuse vahel“.
Kuigi käte desinfitseerimisvahendid peaksid täpselt loetlema märgistatud koostisosad (ja ei ole sisaldanud 1-propanooli, välja arvatud juhul, kui see vastab FDCA 505-G turustamisnõuetele), kas „käte desinfitseerimisvahendite“ patoloogiline allaneelamine nelja inimese poolt kogu maailmas oli piisav põhjus, et see oleks 53% ja 74% fookus sellest, mida FDA OPQ 1300 töötajat testisid vastavalt 2021. ja 2022. aastal?
FDA OPQ proovide võtmise veebisait näitab tugevalt ebaproportsionaalset eelistust testida siseriiklikult valmistatud tooteid võrreldes välisriikides valmistatud toodetega, vastavalt andmetele, mis põhinevad sellel, mida FDA OPQ on valinud testimiseks aastatel 2013–2023.
Seda hoolimata asjaolust, et sama ajavahemiku jooksul toodeti enamik kaubamärgiga ravimeid (ja umbes 85% geneerilistest ravimitest) välisriikides.
Veebisaidi www.fda483s.com andmetel, hoolimata asjaolust, et valdav osa farmaatsiatootmisest toimub Hiinas ja Indias, väljastati aastatel 2013–2019 FDA 2344 rikkumisest ainult 243 (st umbes 10%) Hiina ja India rajatistele.
FDA viib välisriikides toodetud toodetel ainult harva läbi reaalajas isiklikke kontrolle või lõppkasutajate teste. Rahvusvahelised nõuded on oluliselt vaevanõudvamad ja ajamahukamad kui lihtsalt auto või lennukiga riigisiseselt reisimine, et kontrollida kodumaist rajatist, mis nõuab suhteliselt vähe paberimajandust ja rahvusvahelise koordineerimise puudumist valitsuste ja välisministeeriumiga.
Tootjate motivatsioon Hiinasse/Indiasse kolida ei pruugi olla mitte ainult: 1) madalamad tööjõukulud, vaid ka 2) põgeneda FDA järelevalve alt eksprompt ja sagedasemate kodumaiste kontrollide kaudu.
Kuigi välisriikide tootjaid teavitatakse eelnevalt kontrollidest eespool loetletud nõutavate välisministeeriumi protokollist teatamise protsesside kaudu, ei saa kodumaised rajatised mingit teadet ega võimalusi ettevalmistamiseks.
Vaatamata ravimitootmise siirdumine välismaale, näitas Bloombergi artikkel FDA kontrolliandmete ProPublica analüüsist, et agentuuri India ja Hiina ravimitootjate kontrollide arv tegelikult langes.
Tsiteerides katkendit artiklist:
- eelarveaastal, aasta enne COVID-19 pandeemia piiras reisimist ja liikumist, kontrollis FDA 37% peaaegu 2500 välismaisest tootjast; 2022. aastal kontrollis [FDA] ainult 6% umbes 2800-st. Ja Indias… FDA kontrollis 2022. aastal ainult 3% tootjatest (rõhuasetused lisatud).
2021. aasta jaanuaris otsustas FDA hakata jälgima ravimite kvaliteeti tootja tarnitud „posti teel“ proovide kaugkogumise kaudu, mis näiliselt asendab rajatise kontrollide ajal tavapäraseid, isiklikke kogusid. Üks FDA põhjendusi „posti teel“ proovide võtmiseks otseülekannete, isiklike kogude asemel oli Covid, hoolimata sellest, et FDA reklaamis 2020. aasta lõpus saadaval „ohutut ja tõhusat mRNA vaktsiini“.

Ekraanipilt FDA veebisaidilt. „Posti teel“ proovide võtmise paremal olev kuupäev oli 25.01.2021, hoolimata sellest, et modRNA süstid olid lubatud ja saadaval 2020. aasta detsembris. Kuigi see on pärit FDA bioloogiliste ainete hindamise ja uuringute keskusest (Biologics Evaluation and Research, CBER), eeloleval pildil on FDA 2024. aasta jaanuari juhenddokumendi esimene leht, milles öeldakse, et tootja, ise esitatud „posti teel“ proovide metoodika testimiseks on täiustatud kõigis FDA osakondades.
- aastal jätkas FDA püsiva „posti teel“ proovivõtumetoodika edendamist kogu agentuuris. Kui paluda tootjatel esitada kvaliteedi testimiseks „posti teel“ näidiseid, jätab see ilmselgelt pettuste suhtes haavatavuse.
Suur osa Hiina ravimitootjatest on riigi omandis, kusjuures täiendavad Hiina eraomanikud on poliitilise liidri tahtele sümpaatsed või muul viisil sunnitud alluma. Kas see kujutab endast ohtu riiklikule julgeolekule?
Kvaliteedikontrolli tulemuste ebateaduslik ekstrapoleerimine:
Et aidata kaasa tarbijate kvaliteedikontrolli turvalisuse illusioonile, avaldas FDA 2022. aasta juulis lavastatud intervjuu oma OPQ kvaliteedikontrolli testimise eest vastutava järelevalvedirektori dr Jennifer Maguire’iga.
Oma intervjuus teatas Maguire, et „väga väike protsent ravimeid ei vastanud kvaliteedistandarditele“. Seda öeldes viitas dr Maguire uuringule, mille kaasautoriks oli tema FDA juhendaja ja OPQ direktor dr Michael Kopcha (farmakoloog ja apteeker). Selles uuringus testiti vaid 252 toodet, mis sisaldasid ainult 17 erinevat toimeainet … 150 000 tootest, mille OPQ ülesandeks on kvaliteedi kontrollimine.
Maguire rõõmustas selle üle, kuidas tema osakond oli läbi viinud „suurima teadaoleva omalaadse valimiuuringu“. See tähendab, et FDA näib olevat sellist ekstrapoleerimist aastakümneid lubanud.
Veelgi hullem: selle väljaande metoodika tundub veelgi vastutustundetum, kui arvestada, et selles uuringus osalenud 217 geneerilisest ravimist, mida ta 2022. aastal oma väite õigustamiseks kasutas, olid ainult ~5% pärit Aasiast ja ainult 36% Indiast, hoolimata sellest, et nendes riikides toodeti peaaegu 100% mittefarmatseutilistest geneerilistest ravimitest ja/või vähemalt ühest nende „ehitusploki“ komponendist, mis täidavad haiglaid ja apteeke.
Jättes kõrvale FDA väljaannete ja jagatud testimisandmete väärtõlgenduse, võib see olla halvim näide kinnituse kallutatusest.
Ilmselgelt on FDA OPQ jälgimisveebisaidi väide „Meie CDER-is oleme pühendunud patsientide ja tarbijate kaitsmisele ohtlike, ebaefektiivsete või halva kvaliteediga ravimite eest“ laialdaselt vastuolus nende tegeliku tavaga näiliselt iseseisvalt koguda ja testida ainult 0.001% nende reguleeritavatest toodetest.
- aasta detsembri väljaandes kirjeldati üksikasjalikult, et FDA tagasikutsumised, mis on seotud ravimite tootmise kvaliteediga: aastatel 2018–2022 on enam kui kahekordistunud. Täpsemalt, STAT uudiste (Boston Globe’i lisaväljaanne) andmetel oli 2018. aastal ainult 22 toote tagasikutsumist, kuid 2022. aastal oli neid 310 – 14x rohkem.
Enamikku, kui mitte iga FDA tagasikutsumist oleks saanud potentsiaalselt vältida, kui FDA oleks tooteid otseselt ja põhjalikumalt testinud, enne kui need jõuavad turustajate, haiglate või apteekideni.
Surmad ja rasked vigastused, mis on põhjustatud ravimite kogumise ja testimise puudumisest FDA poolt:
FDA kohustus tagada ravimite puhtus pärineb algsest põhjusest, miks see asutati juba 1906. aastal. Toona kodifitseeris kongress puhta toidu ravimite ja kosmeetikatoodete seaduse seaduseks, peamiselt selleks, et tagada toote koostisosade loetlemine ja täpne loetlemine.
Kui FDA ignoreerib oma kohustusi tagada kvaliteedikontrolli paljudes toodetes, tekivad äärmiselt tõsised ja/või surmavad tagajärjed. Järgmine näidete loetelu ei ole mingil juhul täielik ja sisaldab järgmist:
- 2023. aasta novembri aruandes kirjeldati üksikasjalikult, kuidas Indias valmistatud kunstpisarad, mida müüakse laialdaselt Walmartis, CVS-is ja Targetis (ettevõttesiseste kaubamärkidena), tuli apteegiriiulitelt tagasi kutsuda pärast seda, kui leiti, et need on toodetud Indias asuvas rajatises, kus tootjad võltsisid reguleerivatele asutustele esitatud testitulemusi.
- Eraldi põhjustasid 2022. aastal Indiast imporditud määrdunud kunstpisarad nelja inimese surma ja veel 18 nägemise kaotuse. Mõnel juhul olid infektsioonid nii rasked, et patsiendid pidid laskma oma silmamunad kirurgiliselt eemaldada.
- 5. veebruaril 2024 väljastati veel üks kiireloomuline (1. klass) tagasikutsumine 27 laialdaselt kättesaadava silmatilga kohta. I klassi tähistus on FDA kõige tõsisem tagasikutsumise kategooria ja hoiatab, et tagasikutsutud toodete kasutamine võib põhjustada „… tõsised kahjulikud tagajärjed tervisele või surm.“ Silmatilku toodeti välismaal ja levitati tarbijatele laialdaselt peaaegu kõigis ketiapteekides.
- 2024. aasta juunis kutsuti nakatunud silmatilkade müügi tõttu tagasi CVS-i ja Cardinal Healthi kaubamärgiga tooted. Selles, mis pidi olema steriilne tootmisüksus (haigla kirurgiline operatsioonituba), nägi inspektor pealt, kuidas töötajad kõndisid paljajalu ringi ja „harjasid [oma] juukseid“.
- Teises 2024. aasta juuni kontrollis jagasid imikutele mõeldud ninaspreid pestitsiidide valmistamiseks kasutatavaid seadmeid.
- Viimase 10 aasta jooksul on CVS ohutusprobleemide tõttu tagasi kutsunud 133 käsimüügis olevat geneerilist ravimit. CVS on tellinud geneeriliste ravimite tootmise allhanke korras vähemalt 15 tootjalt, keda on nimetatud probleemideks, vahendab Bloomberg. Teised jaeapteegid, mis müüvad maja kaubamärgiga tooteid, olid vaid mõnevõrra paremad:
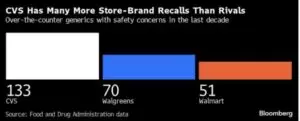
FDA OPQ keskendub oma sõltumatule kogumisele, testimisele ja kontrollitegevusele piiritusetehastele ja „käte desinfitseerimisvahenditele“. Graafiline allikas: Bloomberg, c/o Crain’s Chicago Business. Arhiivi link siin.
- 2019. aastal leidis Toidu- ja Ravimiameti kontroll, et ravimit toodeti Indias asuvas rajatises, kus töötajad kõndisid paljajalu ringi, seintelt koorus värvi ja proovides kerkisid bakterid. FDA vastus oli lihtsalt anda tarbijatele hoiatus, et nad ei võtaks silmatilku tagasi 2019. aasta oktoobri lõpus, kuid need jäid poeriiulitele vähemalt kaks nädalat pärast seda. Patsientidel, kes olid võtnud sellest tehasest valmistatud silmatilku, tekkis nägemise kaotus.
- 2023. aasta juunis Gujarat, Ahmedabad, Indias asuv Intas Pharma, kes on USA-le peamine kemoterapeutiliste ravimite, nagu tsisplatiin ja karboplatiin, tarnija, leidis, et neil on suured tootmis- ja andmete terviklikkuse probleemid, mille tulemuseks on arvukad FDA hoiatuskirjad. Intas tootis halva kvaliteediga tooteid, sellest johtuvalt jäid patsiendid, kes juba kannatasid günekoloogiliste, pea-, kaela- ja põie pahaloomuliste kasvajate all, ravimata ja/või neile võidi anda võltsitud kemoterapeutilisi tooteid. Ükski teine nende toodete tarnija ei olnud kättesaadav, sest Intas oli löönud alla oma tootmiskonkurente, lõigates raha säästmiseks väidetavalt nurki. FDA pani Intas Pharma „impordihoiatusele“, mis hõlmab laialdase suhtluse saatmist pakkujatele, tavaliselt vananenud viisil, milleks on kirja saatmine posti teel. Kuigi FDA „impordihoiatus“ ei konfiskeeri ega „kutsu tagasi“ olemasolevaid tooteid, mis on juba haiglates, apteekides ja arstikabinettides olemas.
- 2023. aasta juulis leiti, et Indias New Delhis Pitapuras asutatud ravimifirma Maiden Pharmaceuticals Ltd valmistatud dekstrometorfaanil põhinevad köhasiirupid on toodetud toksiliste tööstuslike lahustitega, sealhulgas saasteainetena dietüleenglükooli ja etüleenglükoolina. Köhasiirupeid jagati 18 kuu jooksul 10 riigis, mille tagajärjel suri vähemalt 66 last lisaks ütlemata sadadele lastele, kes kannatasid püsiva neerukahjustuse all.
Aruannete kohaselt, köhasiirupit tootnud asutus:
„…haiguspuhangule eelnenud aastatel korduvalt ebaõnnestunud kvaliteeditestid. Üks nõuetele mittevastavate preparaatidega seotud kohtuasi venis India sklerootilistes kohtutes üheksa aastat, enne kui see tehnilisel põhjusel tagasi lükati. Teine [juhtum] kestis 12 aastat ja selle tulemuseks oli trahv 1000 ruupiat ehk umbes 15 dollarit sel ajal.“
Üldiselt püsib Indiast pärit toodete 2024. aasta farmatseutiline kvaliteet jätkuvalt ning farmaatsiakvaliteedi eksperdid on seda tabavalt kirjeldanud kui „kurba“ ja pundid kui „lõputut kvaliteedikadude saagat“. Need aegumised on otseselt tingitud kehvast tootmiskontrollist, millele lisandub FDA sügav järelevalve puudumine imporditavate lõpptoodete reaalajas tehtavate isiklike kontrollide ja analüütiliste testide näol.
Tõepoolest, kui FDA oleks kasutanud oma varasemat kuue pluss miljardi dollari suurust aastaeelarvet – millest pool on suvalised kulutused –, et seda ja teisi silmatilku enne apteekidesse jõudmist põhjalikumalt kontrollida ja/või testida, oleks neid surmajuhtumeid ja pimedaks jäämise juhtumeid võinud ära hoida.
Nii tootjate kui ka FDA juhtkonna käitumist ennustati umbes 25 aastat tagasi suure Thomas Sowelli kaudu, kes ütles: raske on ette kujutada rumalamat või ohtlikumat viisi otsuste tegemiseks, kui anda need otsused inimeste kätte, kes ei maksa eksimise eest mingit hinda.
Iroonilisel kombel viitas Sowell ka siis oma tsitaadiga ravimiohutusele.
Tegelikult oli ainus mõttekas hind, mida maksti vale olemise eest, kui tegemist oli halva tootmisega. See hõlmas New England Compounding Centersi proviisoreid Glenn Chini ja apteegi juhendajat Barry Gaddenit, kes mõlemad seisavad silmitsi umbes kümne aasta pikkuse vanglakaristusega tapmise eest pärast seda, kui nad tootsid oma sõltumatus apteegis saastunud steroide, mis on veel üks näide väikeettevõtte sihtimisest, samas kui ravimi- ja farmaatsiatööstuse tootjaid ei süüdistata potentsiaalselt võrdsete või veelgi hullemate kuritegude eest.
Kuigi on olemas väliseid laboreid, mis reklaamivad ravimite testimise teenuseid, tundus üks selline ettevõte, Valisure, et kaitsta patsiente halva kvaliteediga toodete eest, tegelikult pigem tootjate „raputamis“ sularaha eest, selle asemel, et ignoreerida inimeste kaitsmist, vahendab Wall Street Journal. Sellegipoolest ei ole see takistanud Valisure’il tegemast ettepanekut testida ravimites sisalduvaid „lisandeid“, kuid lisandid ei ole kõikehõlmavad ja on ainult osa loost, sest see ei tee nulli, et käsitleda kvantitatiivseid (milligrammi tugevusega) ekskursioone või bioloogilist saastumist.
Vaatamata Valisure’i nimele („valideerimise“ ja „kindluse“ näiline ühendamine) ei paku see kumbagi. Selle nn lasertestimise metoodika töötati välja väljaspool Valisure’i. Lisaks on Valisure’i lasertestimise metoodikad väga eksotermilised, mis lagundavad ja/või tekitavad toksilisi kõrvalsaadusi. Teadaolevalt kuumus muudab paljude kemikaalide, sealhulgas ravimite koostist. Valisure’i kogu ärimudelit olid kohtunikud, õigusteadlased ja teaduseksperdid nimetanud „rämpsteaduseks“, samuti Wall Street Journali toimetus ja sõltumatu analüütiline keemik.
Justkui sellest ei piisaks, süüdistati Valisure’i ka FDA õigus- ja vastavusosakonna poolt paljude regulatiivsete rikkumiste toimepanemises, kuna teda süüdistati kohtus valede teaduslike väidete esitamises. FDA puudumisel kasutavad välised, madala rendiga, ise märgistatud „kvaliteedi tagamise“ teenused (sealhulgas Valisure) ära FDA olulisi lünki testimises ja läbipaistvuses, et reklaamida oma testimisteenuseid teadmatule klientuurile, mis murettekitavalt hõlmab Pentagoni.
GMP-sertifikaadiga ravimite vabastamise testimine (kunsttermin) on ainus viis farmaatsiatoote nõuetekohaseks testimiseks kõigi kvalitatiivsete ja kvantitatiivsete ekskursioonide jaoks. See on midagi, mida FDA on kohustatud tegema oma rahvatervise missiooni osana ja lisaks on selleks lisaks nii töötajad kui ka suvakohased kulutused.
FDA väljastatud 2023. aasta septembri rikkumine andis tarbijatele ainult Hiinas asuva Sichuan Deebio farmaatsiatehase piinavalt üle redigeeritud kontrolliaruande. Selle konkreetse FDA kontrolli ajal näis tehase kvaliteedikontrolli juht valetavat (või nagu inspektorid seda viisakalt kirjeldasid, andsid „eksitavat teavet“) kriitiliste testitulemuste ja arvestuse pidamise kohta.
Sichuan Deebio kvaliteedikontrolli juhendaja tühistas avaldused FDA inspektoritele tehtud kvaliteedikontrolli dokumentide ja arvestuse pidamise kohta (rohkem kui üks kord), pöördudes lõpuks tagasi oma algse avalduse juurde. Lõpuks ta tunnistas, et „ei räägi tõtt tulemuste salvestamise kohta vastavatele andmetöölehtedele“, tunnistades lisaks, et olulist kirjet/töölehte pole kunagi olemas olnudki. Olukorra halvendamiseks küsisid uurijad hiljem kvaliteedijuhilt, kuidas ta jälgis neid väga spetsiifilisi testitulemusi, millele ta vastas, et need on „tema meelest“.
FDA avalikult kättesaadav aruanne, milles kirjeldatakse üksikasjalikult selle kontrolli muid üksikasju, on enamasti loetamatu pärast FDA näiliselt hüperaktiivseid „(b)(4)“ redaktsioone. Tuleb märkida, et FDA peab „(b)(4)“ redaktsioone „ärisaladuseks“, kuigi kontrollid on otseselt seotud rahvatervisega.
Lisaks on olemas pikk ajalugu FDA dokumentidest, kirjadest ja aruannetest, mis pärast FDA redaktsiooni loevad salajasi Pentagoni või CIA aruandeid või 1950. aastate laste „Mad Libs“ sõnamänge, mitte kriitilisi HHS / rahvatervise dokumente, mis on olemas avalikkuse teavitamiseks olulistest ohutusprobleemidest.
Selleks on siin mõned väljavõtted Sichuan Deebio tehase FDA kontrolliaruande teabevabaduse seaduse (FOIA) versioonidest. Pärast redigeerimist on üldiselt võimatu mõista, milliseid konkreetseid lisandeid või lisandite astet FDA ametnikud avastasid. Isegi mõjutatud partiide numbrid võeti tagasi, takistades tarbijatel ise kontrollida, milliseid konkreetseid ravimeid/partiisid see mõjutas.

Sichuan Deebio veebisaidi väline ingliskeelne versioon on ebajärjekindel ja/või näib omavat fotosid oma rajatisest, mis on laos ja/või võltsitud ja/või ilmselgelt arvuti loodud ja/või logistiliselt ebareaalne. Selgelt palju hoiatusi, mis seavad veelgi kahtluse alla peaaegu kõige selle, mida Sichuan Deebio esindab.

Sichuan Deebio tootmisrajatiste „Taimekeskkond“ ja „Haldushoone“ reklaamitud pildid ning mitmesugused muud selle veebisaidil näidatud pildid näivad olevat arvuti loodud.
FDA sõltumatute ja põhjalike farmatseutiliste testide puudumine ei ole tingitud FDA personali, rahastamise või muude ressursside puudumisest. Selle põhjuseks on juhtkonna näiline ükskõiksus, et nad ei vastuta kellegi ees selle eest, kuidas nad oma raha kulutavad.
Viimased arvud näitavad, et FDA 2024. aasta eelarve paisus 7,2 miljardi dollarini, millest umbes pool on täiesti suvaline.
FDA on andnud oma ligi 20 000 töötajale ühe valitsusasutuse kõrgeima palga – ja see on lisaks sellele:
- 3,1% palgatõus 2020. aastal,
- pluss 2,7% palgatõus 2022. aastal,
- pluss 4,6% palgatõus 2023. aastal
- pluss 5,2% palgatõus 2024. aastal.
- aastal oli FDA kõige kõrgemalt tasustatud tööandjate seas 108. kohal; FDA töötajad on tänase seisuga selle näitajaga veelgi paranenud.
Kokkuvõte:
Patsiendid, kes loodavad ravida kriitilist meditsiinilist seisundit, võivad selle asemel kahjustada toksilisi, vale tugevusega või muul viisil ebapuhtaid tooteid, mis varjatult ja kahjulikult muudavad nad veelgi haigemaks.
Apteekritel ja arstidel on patsiendihoolduskohustusi ning nad ei peaks täiendavalt kaaluma toksiliste / halva kvaliteediga ravimite võimalust täiendava võimaliku komplitseeriva tegurina.
Presidendi ja Robert F. Kennedy koostöö on muuta riik taas terveks. Osa sellest peab rakendama ka kohest ja palju rangemat järelevalvet ravimite üle.
Kaks parimat viisi ravimite kvaliteedi edendamiseks eksisteerivad FDA sõltumatu kogumise ja kontrollimise ristumiskohas, enne kui nad patsientideni jõuavad, koos jätkuva propageerimisega farmaatsiatootmise tagastamiseks, kus tootjaid saab vigade ilmnemisel paremini jälgida ja vastutusele võtta. Lisaks kõrgtehnoloogiliste töökohtade tagasitoomisele võimaldaks see FDA rutiinset ja kohest juurdepääsu tootmisettevõtetele etteteatamata kontrollideks. Tegelikult oli see ettevõtmine juba alanud algatustega Phlow Corporationi kaudu, et toota farmaatsiatoodete tootmiseks lähteaineid „ehitusplokke“.
Kui eeltoodud loetletud näidetes on aastakümnete pikkused halva kvaliteedi ja pettuste kogemused, siis kuidas ei saaks ravimiamet testida kõike, mis väljast riiki tuleb, ilma sõltumatu kogumise ning lõpliku ja läbipaistva kvaliteedikontrollita? See pole mitte ainult vastutustundetu patsientide, apteekrite ja arstide suhtes, kes sõltuvad ravimite kvaliteedi kontrollimisel tervise parandamiseks. Kvaliteedi kontrollitud ravimite puudumine kujutab endast ohtu riiklikule julgeolekule.
Ilmselgelt on kõige mõistlikum strateegia kõigi ravimite sõltumatu ja perspektiivne valik ja testimine kvaliteedi tagamiseks partiide kaupa reaalajas sisenemissadamates, jaotuskeskustes või hulgimüügiladudes – enne kui need haiglatesse või apteekidesse saadetakse – lisaks regulaarsetelt tootmisrajatiste kontrollidele.
Ravimiamet ei kasuta ennetavat metoodikat, et vältida halbade toodete sattumist apteegiriiulitele, võivad inimesed oodata lõputuid, faktijärgseid tagasikutsumisi, püsivaid vigastusi ja surmajuhtumeid, mis on otseselt seotud ravimiregulaatori olemasoleva ajutise, kauge, minimaalse ja metoodiliselt sanktsioneerimata testimise ja järelevalvega.
Toimetas Revo Jaansoo (08.11.2024)
Kogu artiklit saab vaadata: Brownstone’i instituut
⃰
Gortler on farmakoloog ja endine FDA kõrgema juhtkonna meeskonna liige, kes töötas voliniku vanemnõunikuna järgmistes küsimustes: FDA regulatiivsed küsimused, ravimiohutus ja FDA teaduspoliitika. Ta on endine Yale’i ülikooli ja Georgetowni ülikooli farmakoloogia ja biotehnoloogia didaktiline professor. Ta töötab ka eetika- ja avaliku poliitika keskuse teadlasena ning 2023. aasta Brownstone’i stipendiaadina.