Rahvusvaheliselt tunnustatud molekulaargeneetik ja New Yorgi linnaülikooli emeriitprofessor PhD Corinne Michels selgitab oma hiljutises aruandes: „’Pandemic’ of Sloppy COVID-19 PCR Testing Produced Countless False Positives and a Highly Inaccurate Picture of the True Number of Cases“, kuidas pandi toime COVID-19 RT-PCR-testimise pettus.
„COVID-19 PCR-testid olid pettus“
Olete seda varem kuulnud, kuid kas see on tõsi või on see lihtsalt rohkem hüpe? Lugege seda aruannet ja otsustage ise. See selgitab RT-PCR (pöördtranskriptaasi – polümeraasi ahelreaktsiooni) testikomplektide põhialuseid neile, kes soovivad fakte mõista. Ärge oodake kerget lugemist. Alustuseks peate end kurssi viima DNA põhistruktuuriga. Kui mõistate, kuidas COVID-19 pandeemia tekitamiseks kasutati RT-PCR-testi tulemuste valesti tõlgendamist, saab see olla teile kasulik [rõhuasetus lisatud]. Teid vaktsineeritakse tulevaste jõupingutuste vastu hirmu ja ühiskondliku ebakõla tekitamiseks. Võite olla kindel; nad proovivad uuesti!
Tõsine gripitaoline hingamisteede haigus hakkas levima 2019. aasta sügise alguses, kui Hiinas Wuhanis asuti nullpunktiks. Detsembriks oli haiguse ülemaailmne levik. Pildid õnnetutest jalakäijatest, kes ootamatult tänavatel surnuks langevad; ülekoormatud haiglad Lombardias, Itaalias; valitsuse kehtestatud sulgemised; ja ülemaailmse COVID-i surmajuhtumite pidev kajastamine õhutas selle tundmatu haiguse ümber hirmuleeki. Sellest ei piisanud, et olla sümptomitevaba. Inimesed nõudsid testi väljatöötamist nakkustekitaja vaiksete kandjate tuvastamiseks.
Sel ajal oli teada ainult SARS-CoV-2 genoomijärjestus ja ainus saadaolev testimismeetod kasutas polümeraasi ahelreaktsiooni ehk PCR-i. Vaatamata paljudele teadaolevatele vastunäidustustele algas RT-PCR laialdane COVID-19 testimine. Johns Hopkinsi epidemioloogi ja Ameerika Tervishoiu Epidemioloogide Ühingu (Society of Health Care Epidemiologists of America) endise presidendi dr Trish M. Perli sõnul põhjustab pime usk tehniliselt keerukate molekulaartestide tulemustesse „pseudoepideemiaid“. [ https://www.nytimes.com/2007/01/22/health/22whoop.html ] COVID-19 pandeemia oli üks neist.
Isegi Nobeli preemia võitnud PCR leiutaja Kary Mullis poleks seda heaks kiitnud. PCR muutis pöörde bioteadustes, eriti molekulaarbioloogias. See erakordne biokeemiline tööriist hõlbustas igasuguseid tehnikaid, mis ilma selleta olid peaaegu võimatud. Kahjuks ei kuulu PCR-i oskuste hulka elujõulise nakkustekitaja olemasolu demonstreerimine. Kuigi Mullis rääkis HIV-st, sobib järgnev tsitaat siiski COVID-19 puhul. „[PCR] ei ütle teile, et olete haige või et asi, millega te lõpetasite, teeb teile haiget või midagi sellist.“ Mullis jätkab: „See võimaldab teil võtta väikese koguse kõike ja muuta see mõõdetavaks ning seejärel sellest rääkida.“ [ https://off-guardian.org/2020/10/05/pcr-inventor-it-doesnt-tell-you-that-you-are-sick/ ]
Lõpuks polnud probleemiks mitte PCR tehnika, vaid tulemuste petlik analüüs. Tsiteerides Mullist: „Ma ei usu, et saate PCR-i kuritarvitada. [See on] tulemused; selle tõlgendus. Kui nad suudavad selle viiruse sinust üldse leida – ja PCR-iga, kui teete seda hästi, võite leida peaaegu kõike.“ [ https://off-guardian.org/2020/10/05/pcr-inventor-it-doesnt-tell-you-that-you-are-sick/ ] FDA [USA Toidu- ja Ravimiamet], kes kiitis heaks kaubanduslikud RT-PCR testikomplektid COVID-19 ja välja töötanud esimesed komplektid, oleks pidanud olema teadlikud võimalikust väärkasutusest. Nende kohustus oli panna paika kaitsepiirded, et vältida väärkasutamist. Samuti CDC-d [terviseametid] oleks pidanud teavitama. Asjaolu, et FDA vaikis või lasi sellel juhtuda, räägib palju.
Mis on PCR?
PCR on molekulaarne koopiamasin, mis on võimeline tootma triljoneid koopiaid DNA molekuli lühikesest lõigust. See tugineb DNA sünteesi masinate omadustele, mis on ilmnenud aastakümnete pikkuse uurimistöö käigus, mille eest paljud on saanud Nobeli auhindu.
- PCR kasutab spetsiaalset termostabiilset DNA polümeraasi, DNA-d sünteesivat ensüümi, mis talub kuumutamist temperatuurini 92 ° C kuni 98 °C.
- DNA polümeraas teeb koopiaid „matriitsi“ DNA molekulist, nõudes malli ja see ei saa alustada DNA sünteesimist kõikjal DNA mallis. See liigub mööda ühte DNA matriitsi ahelat, lisades korraga ühe nukleotiidi (aluse). Äsja sisestatud nukleotiidalus on „komplementaarne“ matriitsi ahela alusega. Täiendavad nukleotiidide paarid on järgmised. A on komplementaarne T-ga ja G on komplementaarne C-ga.
- DNA üksikutel ahelatel on keemiliselt erinevad otsad, mida nimetatakse 5′- ja 3′-otsteks. DNA polümeraas suudab uut DNA ahelat sünteesida ainult vaba 3′ otsaga kinnitumisel. PCR-is annab vaba 3′-otsa lühike üksik nukleotiidide ahela, pikkusega umbes 12 kuni 20 nukleotiidi, mida nimetatakse „praimeriks“. DNA polümeraas alustab DNA sünteesimist, kinnitudes praimeri 3′-otsa.
- PCR kasutab praimerite paare, et teha praimeritevahelisest DNA lõigust mitu koopiat. Kaks praimerit määravad kopeeritava jaotise otsad. Praimerite järjestus tuleb hoolikalt määrata, et see oleks komplementaarne unikaalsete järjestustega matriitsi DNA vastasahelates. Unikaalsete järjestuste äratundmine praimerite abil on see, kuidas PCR eristab teisi lähedalt seotud inimese koroonaviirusi, mis on populatsioonis endeemilised, ja SARS-CoV-2.
- Temperatuuril 37 o C kuni 65 o C paaristuvad praimerid oma komplementaarse järjestusega, seda protsessi nimetatakse anniilimiseks. Praimeri lõõmutamise täpsus ja rangus sõltuvad praimeri pikkusest, selle G/C sisaldusest ja kasutatavast anniilimistemperatuurist. Mida kõrgem on anniilimistemperatuur, seda rangem on praimeri ja sihtkoha vahel nõutav järjestuse komplementaarsus. Iga praimeri jaoks on lihtne välja arvutada õige lõõmutamistemperatuur kõrge rangusega sidumiseks.
- Temperatuuril 92–98 ° C eraldub kaheahelaline DNA üksikuteks ahelateks, mida nimetatakse sulamiseks.
- DNA sünteesi, mis algab praimeri 3′ otsast, nimetatakse „praimeri pikenduseks“ ja see toimub temperatuuril 72 C.
Tüüpiline PCR reaktsioonisegu sisaldab (1) termostabiilset DNA polümeraasi, mis talub temperatuuri kuni 92 o C kuni 98 o C; (2) praimerite paar; (3) sihtmärk-DNA; (4) kõik neli nukleotiidi (A, T, C, G) alust ja (5) puhvreid ja soolalahuseid. PCR reaktsioonisegu asetatakse väga väikesesse koonilise põhjaga plasttorusse, mis mahutab ainult 10 või vähem tilka reaktsioonisegu.
See toru sisestatakse PCR termotsükleri termoplokki. Tüüpiline termoplokk on umbes 7 ruutsentimeetrit ja üks kuni kaks sentimeetrit paks. See sisaldab mitut süvendit, mille suurus sobib ideaalselt PCR-reaktsioonides kasutatavate koonilise põhjaga plasttorudega. Tüüpiline aukude arv on 96, mis on paigutatud kaheksasse 12-st reast. Termoplokk asetatakse PCR termotsükleri „temperatuurivanni” ja kõik torud suletakse oma kohale.
Termotsükler tõstab ja langetab termoploki/reaktsioonitorude temperatuuri kiiresti mõne sekundiga. Seda juhib arvuti ja selle sisestab tehnik. Iga tsükli temperatuur ja ajad on erinevad. Iga PCR-tsükkel koosneb järgmistest temperatuurimuutuste seeriast ja võtab vaid mõne minuti.
- Temperatuuri tõstetakse, et võimaldada kõigil DNA ahelatel eralduda üksikuteks ahelateks.
- Temperatuuri alandatakse soovitud anniilimistemperatuurini, et praimerid saaksid siduda oma ainulaadse komplementaarse järjestusega.
- Temperatuur tõstetakse 72 o C-ni, et võimaldada termostabiilsel DNA polümeraasil pikendada praimerit ja toota DNA ahela, mis on komplementaarne siht-DNA matriitsiga.
Pöördtranskriptaas
SARS-CoV-2 on üheahelaline RNA, mis toimib raku nakatamisel valgusünteesi sõnumitooja RNA-na (mRNA). PCR vajab DNA sihtmärki. Seega, et kasutada PCR-i SARS-CoV-2 olemasolu tuvastamiseks, tuleb see RNA esmalt kopeerida DNA-sse. Selleks kasutatakse spetsiaalset DNA polümeraasi, mida nimetatakse pöördtranskriptaasiks, mis kasutab RNA-d matriitsina komplementaarse DNA ahela sünteesimiseks.
RT-PCR testi protseduur
- samm: ekstraheerige nina tampoonist RNA. See hõlmab mis tahes SARS-CoV-2 RNA-d pluss peremees-RNA-d ja muid nasaalseid saasteaineid.
- etapp: pöördtranskriptaasi kasutatakse SARS-CoV-2 RNA spetsiifilise sektsiooni DNA komplemendi sünteesimiseks. Diagrammil on selle etapi RT-praimer (roheline) komplementaarne ainulaadse järjestusega SARS-CoV-2 3′-otsas, N-geeni kõrval asuvas transleerimata piirkonnas. Toodetud DNA ahel ulatub vaid mõnesaja aluse võrra N-geeni. See ei sisalda Spike’i geeni ega muid selle peaaegu 30 000 nukleotiidi pikkuse genoomi geene. See on oluline punkt! Testitakse ainult N-geeni olemasolu. (Teisi SARS-CoV-2 RNA piirkondi saab testida seni, kuni kasutatakse ainulaadset RT-praimeri järjestust.)
- samm: tõstke temperatuuri, et eraldada lühike DNA ahel SARS-CoV-2 RNA-st.
- samm: alandage temperatuuri, et PCR-i segu praimer 1 (punane) saaks paarituda (anniileerida) N-geeni DNA ahelaga. Praimer 1 on komplementaarne ainulaadse lühikese järjestusega, mis on N-geeni piiri sees.
- samm: tõstke temperatuur umbes 72 o C-ni, et võimaldada temperatuuristabiilsel DNA polümeraasil sünteesida DNA komplementaarset ahelat, mida nimetatakse praimeri pikenduseks.
- samm: DNA ahelate eraldamiseks tõstke temperatuuri.

Kuni kasutatud praimerid paarituvad SARS-CoV-2 RNA-le ainulaadsete järjestustega, tuvastab RT-PCR test ainult SARS-CoV-2 RNA. Kui praimerite järjestus on mingil põhjusel valesti otsustatud, test on vigane ja annab valed tulemused. [Borger, Pieter, Malhotra, Rajesh Kumar, Yeadon, Michael, Craig, Clare, McKernan, Kevin, Steger, Klaus, … Kämmer, Ulrike. (2020). „External peer review of the RTPCR test to detect SARS-CoV-2 reveals 10 major scientific flaws at the molecular and methodological level: consequences for false positive results” [SARS-CoV-2 tuvastamise RTPCR-testi väline eksperthinnang paljastab 10 peamist teaduslikku viga molekulaarsel ja metodoloogilisel tasandil: valepositiivsete tulemuste tagajärjed]. http://doi.org/10.5281/zenodo.4298004 ]
Etapp 1 toodab SARS-CoV-2 RNA N geeniosa RNA/DNA hübriidi. PCR tsükkel 1 toodab ühe kaheahelalise DNA fragmendi, mis on kopeeritud praimeripaari vahelisest piirkonnast. Tsükkel 2 valmistab sellest fragmendist kaks koopiat; 3. tsükkel valmistab neli koopiat; ja nii edasi. Toodetud kaheahelalise DNA kogust saab erinevate meetoditega hõlpsasti kvantifitseerida ja seda saab teha kuumutusplokkide reaalajas termotsüklerites.
Ühe algkoopia põhjal saadakse 25 tsükliga 335 543 936 koopiat ja 45 tsükliga 3 474 749 302 776 koopiat. Kui lähtereaktsioonisegus on rohkem kui üks koopia, saavutatakse need arvud pärast vähemate tsüklite arvu. Teisisõnu, mida vähem on fragmendi tuvastamiseks vaja tsükleid, seda suurem on sisendkoopiate arv.
DNA-d siduvad „sondid“ vabastavad fluorestseeruva värvimolekuli iga kord, kui DNA fragmenti kopeeritakse. Kui vabaneb minimaalne arv värvimolekule, hakkab PCR reaktsioonisegu fluorestseeruma. Termotsükler jälgib iga reaktsioonitoru florestsentsi ja tsüklite arv registreeritakse. Vaadake RT-PCR tulemuste tüüpilist graafikut.

Kui RT-PCR testimine läks valesti
PCR nõuab spetsiaalset varustust ja väljaõpet mitte ainult protseduuride nõuetekohaseks läbiviimiseks, vaid ka tulemuste korrektseks analüüsimiseks. 3. veebruariks 2020 olid USA Haiguste Tõrje ja Ennetamise Keskus (CDC) välja töötanud esimese RT-PCR testikomplekti. Varsti töötati välja kümneid teisi kaubanduslikult toodetud RT-PCR testimiskomplekte. Niisiis, mis võib valesti minna? Tonni asju! Allpool on loetletud vaid mõned kõige olulisemad. [ https://dailysceptic.org/2020/11/30/the-pcr-false-positive-pseudo-epidemic/ ]
- Nagu on märgitud CDC RT-PCR testikomplekti juhendis, [see] on ette nähtud kasutamiseks laborites, mille CDC on määranud kvalifitseerituks ja „piirdub kliiniliste laborite täiustamise muudatuste ([Clinical Laboratory Improvement Amendments,] CLIA) alusel sertifitseeritud laboritega, mis vastavad nõuetele: kõrge keerukusega testide tegemiseks”. [ https://www.fda.gov/media/134922/download ] See kehtis loomulikult kõigi RT-PCR testikomplektide kohta. Miljardeid PCR-teste viidi läbi kümnetes tuhandetes kohtades, millest enamik ei olnud CLIA-sertifikaadiga. See on võrreldav sellega, et kohalik garaažimehaanik võiks oma Ferrari 12 Cilindri mootorit häälestada. Testimiskohtade arvu plahvatuslik suurenemine suurendas testimisvigade tõenäosust.
- Ülaltoodud diagrammi kõige olulisem sõnum, et RT-PCR test ei tee vahet kogu viiruse ja viiruse RNA genoomi fragmentide vahel. See on võimeline näitama AINULT SARS-CoV-2 fragmentide olemasolu. Seda ei saa kasutada nakkavate (kapseldatud) viirusosakeste esinemise indikaatorina tampoonis. RT-PCR-testi tulemuste väär tõlgendamine selgitab „asümptomaatilise kandja“ põhjuseid, väiteid, et nii paljudel muudel põhjustel haiglaravil viibivatel inimestel tuvastati COVID-19, ja miks nii suur osa sulgemishullusest, mida me läbi elasime, oli täiesti asjatu. Toimus „testimise pandeemia!“
- Patsientide proovivõtuvead, mis on tingitud „tampoonivõtutehnikate“ ja RNA puhastamismeetodite tõhususe erinevustest, võivad põhjustada 1000–10 000-kordseid erinevusi RNA koguses testitavas proovis. See tähendab erinevusi kuni 10 kuni 13 PCR tsüklit. [Michael Yeadon, „PCR valepositiivne pseudoepideemia“. https://lockdownsceptics.org/the-pcr-false-positive-pseudo-epidemic/ ]
- Katseprotokollid peaksid sisaldama positiivseid ja negatiivseid kontrollproove igas prooviseerias. Need kontrollid oleksid tehnikavigade ja saastumise indikaatorid. RNA laguneb kergesti ja halvad ekstraheerimismeetodid põhjustavad valenegatiivseid tulemusi. Saastumine on PCR-is suureks probleemiks selle äärmise tundlikkuse tõttu ja lohakas tehnika võib viia valepositiivsete tulemusteni. [ https://www.thelancet.com/action/showPdf?pii=S2213-2600%2820%2930453-7 ]
- Oluline analüüsivea allikas RT-PCR testis oli tsüklite piirarvu väljajätmine, mille korral proov loeti positiivseks või negatiivseks. Testimiskomplektide dokumentatsioonis viidati RT-PCR testile kui „kvalitatiivsele“. Teatud arvu DNA sihtmärgi koopiaid sisaldava standardiseeritud proovi lihtne lisamine oleks võimaldanud hõlpsasti kvantifitseerida. See on ilmne ülaltoodud võimenduse joonisel näidatud lahjendusseeriast. Kui seda oleks tehtud, oleks umbes 25-st tsüklist piisanud, et näidata viiruskoormust, mis on piisav tõelise infektsiooni viitamiseks. Testimiskeskused teatasid harva tsüklite arvust, mida nad kasutasid proovi positiivseks nimetamiseks, kuid aruanded näitasid, et tavaliselt kasutati 45–47 tsüklit. See tsüklite arv suudab tuvastada pigem ebaolulisi ninasaasteaineid kui tõelist infektsiooni. [ https://www.journalofinfection.com/action/showPdf?pii=S0163-4453%2820%2930675-7 ]
- Mõnes komplekti protokollis kasutati praimerite ülikõrgeid kontsentratsioone, mis võisid kaasa aidata muude koroonaviiruse tüvede kui SARS-CoV-2 saitidele ebanormaalsele anniilimisele.
- Krundipaari lõõmutamistemperatuur on kriitiline ja seda tuleb hoolikalt seadistada. Erinevate kaubanduslike pakkujate erinevad RT-PCR komplektid kasutasid erinevaid praimerite paare ja seega vajaksid erinevat anniilimistemperatuuri. Kui testimiskoht kasutas erinevaid kaubanduslikke komplekte, oleks olnud ülioluline, et termotsükleri seadmete temperatuurid oleksid iga komplekti tüübi jaoks asjakohaselt seadistatud.
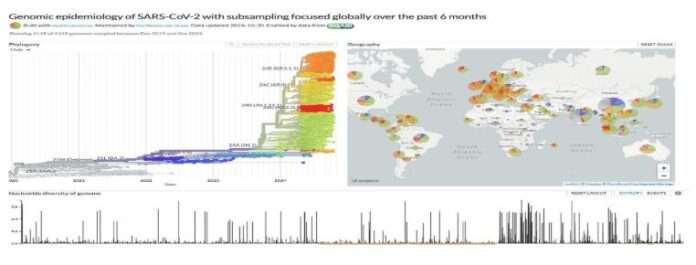
- SARS-CoV-2 levikuga kaasnes sadade variantide kiirendatud tootmine. Viiruse genoomi, sealhulgas N-geeni kogu pikkuses kogunes palju järjestuse muutusi. Selle visualiseerimiseks vaadake NextStraini saidi allolevat ekraanipilti pealkirjaga „Genomic epidemiology of SARS-CoV-2 with subsampling focused globally over the past 6 months” [„SARS-CoV-2 genoomiline epidemioloogia koos viimase 6 kuu globaalse alamproovi võtmisega“]. ( https://nextstrain.org/ncov/gisaid/global/ 6 m )

- Pideva järjestuse varieerumisega sammu pidamiseks on vajalik konkreetse RT-PCR komplekti praimerite komplektide pidev värskendamine. Mõnda, kuid mitte kõiki kommertskomplekte värskendati. Asjakohaselt värskendatud praimeriteta suureneks valenegatiivsete testitulemuste sagedus ja uue SARS2-CoV-2 variandiga haiged saaksid COVID-19 mainekas „kuldstandardi“ testis valesti diagnoosi.
Novembris 2023 sai Acon Flowflexi COVID-19 antigeeni kodutestist esimene kümnetest kodus tehtavatest antigeeni kiirtestidest, mille USA Toidu- ja Ravimiamet (FDA) on COVID-19 nakkuse tuvastamiseks heaks kiitnud. Antigeenitesti komplektid tuvastavad SARS-CoV-2 N kapsiidivalgu olemasolu, mis on oluline valk, mis osaleb viiruse RNA pakkimisel viiruse osakesesse. Neid teste kasutatakse sümptomite esimesel kuni viiel päeval ja need on selged näitajad aktiivsest infektsioonist.
Antigeenide kodutestide kättesaadavus lõpetas üldsuse jaoks RT-PCR testimise hulluse. Veelgi olulisem, et nad juhatasid sisse pandeemiahulluse ja kontaktide jälgimise hulluse lõpu. Haiglad ja arstikabinetid jätkasid RT-PCR testi kasutamist, tõenäoliselt seetõttu, et administraatorid nõudsid seda valitsuse raha.
RT-PCR testimine COVID-19 nakkuse tuvastamiseks oli koletu pettus, mis pandi peale usalduslikule elanikkonnale. COVID-pandeemia oli tõesti testimise pandeemia! [Rõhuasetus lisatud.] Seda kasutati ameeriklaste lukustamiseks, meie isoleerimiseks sõpradest ja perekonnast, ohjeldamatu hirmu tekitamiseks ja valmisoleku tekitamiseks eksperimentaalse vaktsiiniga vaktsineerida. Valitsusel ja rahvatervisega tegelevatel asutustel õnnestus üks kord, sest avalikkus oli naiivne. Nad jätkavad sama nipi kasutamist kuu uusima viirushaiguse maitsega. Järgmisel korral hoiab meid vabana mõistus, mitte irratsionaalne hirm.
Toimetas Revo Jaansoo (09.12.2024)

PhD Corinne Michels on rahvusvaheliselt tunnustatud molekulaargeneetik, kes uurib geeniekspressiooni reguleerimist mudeleukarüootses Saccharomyces cerevisiae, pagari- ja õllepärmis. Tema uurimistööd rahastati järjekindlalt USA Riikliku Terviseinstituudi [US National Institutes of Health] ja Riikliku Teadusfondi [National Science Foundation] toetustest. Ta on kirjutanud rohkem kui 75 teadusajakirja artiklit, ülevaateartiklit ja raamatupeatükki teadusväljaannetes. Dr Michelsi õpikut „Genetic Techniques for Biological Research: A Case Study Approach“ [„Bioloogiliste uuringute geneetilised tehnikad: juhtumiuuringu lähenemisviis”] (John Wiley & Sons) kasutatakse laialdaselt nii klassiruumis kui ka uurimislaboris.