Eesti Eest! portaal saab olla tsensuurivaba ja täiesti sõltumatu -ainult kui toetate meid pisikese annetusega!
Toeta EestiEest.com-i:
Mihkel Johannes Paimla EE407700771008496547 Märksõna "Annetus"
Toeta EestiEest.com-i:
Mihkel Johannes Paimla EE407700771008496547 Märksõna "Annetus"
Võltsingud nn “planeedi soojenemise” ja nn “kasvuhoonegaaside” kohta. Uurimine.
Esimene osa.
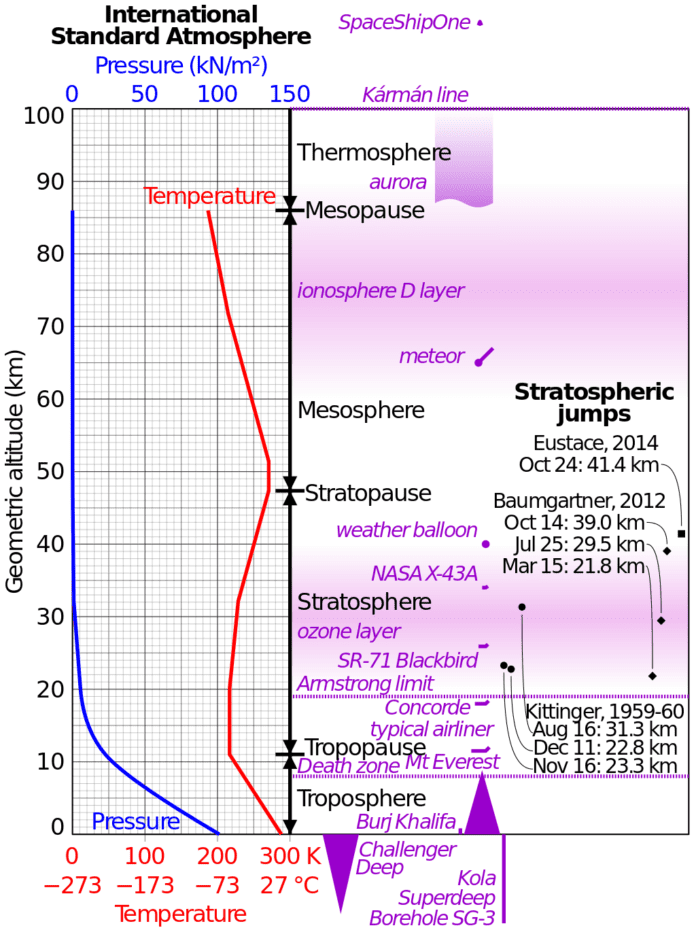
Osoonikiht? Sellist asja nagu “osoonikiht” ei ole olemas!
Atmosfäär on maakera ümbritsev kest, mis on täidetud keemiliste elementide aatomite ja molekulidega. Kõik molekulid koosnevad alati aatomite rühmast (O2, H2O, H2, CO2, …).
Ja sellist kihti ei saa üldse olla.
Ja ei saa olla ka “auke osoonikihis”.
Maa pooluste kohal ei ole ühtegi ja ekvaatori kohal ka mitte. Sest kogu osooni kogus atmosfääris on vaid 3 mm paksune kiht, mis jaotub ühtlaselt maapinnast (ABS=0 – nn merepinnast) ja ulatub maksimaalselt 31 km kõrgusele.
See vastab 300 Dobsoni ühikule ehk 300×2,69×1016 osoonimolekulile Maa pinna ruutsentimeetri kohta.
31 kilomeetri kõrgus on ülemine piir, kus hapnikku (O2) üldse hakkab tekkima.
Sellest kõrgemal on ainult kergemad “väärisgaasid”, mis koosnevad enamasti ainult aatomitest.
Pettus on see, et just “osoon kaitseb Maad” päikese ultraviolettkiirguse eest!
Tegelikult kaitseb Maad hapnik (O2), mitte osoon. Sest osa ultraviolettkiirgusest kasutatakse hapniku lagundamiseks, mis seejärel hakkab moodustuma sekundaarsel kujul osooniks. O2+0=O3.
Osoon moodustub tegelikult kogu 0-31 km kõrgusel asuvas kihis. Isegi ABS-i (merepinnal) moodustatakse seda samamoodi. Näiteks okaspuud Maa pinnal on samuti osooni tekitajad, samuti moodustub see välgu ja äikesetormi ajal 0,5-8 km kõrgusel, samuti moodustavad merede ja ookeanide vetikad osooni, …..
Selle tõestamiseks ei pea olema superteadlane. Selleks on vaja lihtsaid teadmisi koolikeemiast ja vähemalt põhiteadmisi keemiast.
Atmosfäär on Maa ümbrus, mis on täis erinevaid gaase (molekule ja aatomeid).
Maal on gravitatsioon, seega langevad õunad puult Maa pinnale ja ei lenda kuhugi kosmosesse.
Võtmesõna on siin “on gravitatsioon”, mis moodustab mõiste “kaal”.
Vastavalt gravitatsioonile ei lenda kõik atmosfäärigaasid kosmosesse, vaid asuvad alati maapinna lähedal. Mida raskem on gaas, seda lähemal on ta maapinnale. Kõige kergemad “väärisgaasid” asuvad maapinnast kõige kõrgemal.
Näiteks kergete inertsete gaasidega täidetud õhupallid lendavad alati ülespoole, kuid nad jõuavad ainult teatud kõrgusele. Nad ei lenda kunagi kosmosesse, sest gravitatsioon mõjub neile samamoodi ja gaasi enda kaal (kaalupiirang) ei võimalda õhupallil kosmosesse lennata.
Kõik gaasid on mõõdetud ja nende kaal sõltub keemiliste ainete molekulide ja aatomite hulgast rangelt määratletud mahus. Neid koguseid ja kogukaalu mõjutab ka nende molekulide tihedus. Rõhu 0 bar ja rõhu 1 bar juures on kogused ja massid täiesti erinevad.
Seda mahtu nimetatakse “mooliks” ja see on võrdne 22,4 liitri ehk 24,4 dm3 mahuga. 1 m3-s on ainult 44,64 mooli.
Ja kaalumõõtmine toimub ABS tasemel ja Celsiuse temperatuuril ± 0.
Kõigepealt kaalutakse täiesti tühi anum, millest kõigepealt evakueeritakse kogu õhk ja tekitatakse vaakum. Seejärel pumbatakse soovitud gaas sinna ilma rõhuta ja seejärel kaalutakse see maht. See annab gaasi massi grammides/mol.
Tühja ja täidetud mahu vahe moodustab mõiste ” molekulaarkaal”.
Seda ei tohi segi ajada nn ” molekulmassiga”, mida kasutatakse ainult keemiliste elementide massi arvutamiseks ilma gravitatsiooni mõju arvestamata.
Seetõttu on paljude katsete põhjal kindlaks tehtud, et igal gaasil ja keemilisel ainel on oma molekulaarne kaal.
Kõik gaasid atmosfääris on alati paigutatud vastavalt nende molekulkaalule! Kõige raskemad neist asuvad alati Maa pinnale lähemal.
Keemia elementaarsete seaduste kohaselt hakkab kogu nn “kasvuhoonegaaside” teooria kohe kokku varisema. Kui “kliimateadlased” ei tea midagi keemiast, muutuvad kõik nende nn “teaduslikud teooriad” kohe pseudoteaduseks. Seega hakkab skisofreenikute pseudoteaduslik teooria kohe kokku varisema.
Atmosfäärigaaside (kõik inertsed gaasid on siinkohal ära võetud) kaal: esimene näitaja on % atmosfääris, teine näitaja on selle molekuliline kaal.
– Veeaur (H2O)~ 0,2-0,5% kogu atmosfääris – 18,016 g/mol (1+1+16,016)
– Lämmastik (N2) 78,084% – 28,016 g/mol (2×14)
– Hapnik (O2) 20,946% – 32,00 g/mol (2×16)
– Süsinikdioksiid (CO2) 0,03-0,045 % – 44,01 g/mol (12,1+16+16) – 421 osa miljoni kohta (ppm)
– Lämmastikokoksiid N2O – 44,013 g/mol (28+16) – 333 osa miljardi=billioni kohta (ppb).
– Osoon (O3) 0,03 mg/m3 – 48,00 g/mol (3×16)
…
Maapinnale kõige lähemal on alati raskem, osoon (48,00 g/mol (3×16)).
Selle kohal on Lämmastikokoksiid N2O (44,013 g/mol), mida on 1000 korda vähem kui CO2.
Veel veidi kõrgem on CO2 (44,01 g/mol), millest ainult 0,03-0,045 % (333 osa miljardi kohta (PPb)).
Veelgi kõrgem on hapnik O2, mille osakaal on 20,946 protsenti. (32,00 g/mol).
Veelgi kõrgem on puhas Lämmastik (N2), mille osakaal on 78,084%. (28,016 g/mol).
Jääb arusaamatuks, miks CO2 ja mida on väga vähe vulkaanipursetes ei tõuse atmosfääri kõrgeimatesse õhukihtidesse 20-30 km kõrgusele?
Veeaur (H2O) peaks olema veelgi kõrgem. Kuid seda ei juhtu, sest Maal on oma mehhanism, mis piirab auru tungimist atmosfääri kõige kõrgematesse kihtidesse. Seda mehhanismi kirjeldatakse allpool.
Veeauru, mida atmosfääris on vaid 0,2-0,5%, kuulub ka “kasvuhoonegaaside” pseudoteooriasse.
Ja siin on lihtne võltsingut paljastada, sest nn “klimatoloogid” ei tea midagi algkoolikeemiast ja pole üldse kunagi keemia aluseid õppinud.
Miks ei tõuse vojoaur kui kergem keemiline element üles?
Seda ei saa juhtuda, sest atmosfääril on oma kaitsev külm kiht, milles aurumolekulid muutuvad jääks, siis jäävad teised aurumolekulid selle jää külge kinni (tekivad lumehelbed), siis muutuvad nad raskemaks ja langevad loomulikult maapinnale. Vesi naaseb tagasi keskkonda, kus temperatuur on üle nulli. See külm kiht piirab veeauru leviku kõrgust.
Nii näeb see külm kiht välja, millel on kõige tihedam olek tänu miinuskraadide alla jäävale temperatuurile.
Armosfääri temperatuur väheneb vertikaalselt, kui kõrgus merepinnast suureneb 6,5 °C võrra iga 1 km kohta. See tõus jätkub kuni 11 km kõrguseni (kus lennukid lendavad) ja sellel kõrgusel saavutab temperatuur -56,5 °C .
Seetõttu on osa päikese ultraviolett- ja Maa infrapunakiirgusest selles kihis alati vähenenud ja tugevalt pärsitud.
Lisaks võivad need lumehelbed vajuda veidi madalamale, kihti, kus temperatuur on juba kõrgem kui null kraadi Celsiuse kraadi, ja nad võivad taas muutuda endiseks auruks. Nii võib see protsess jätkuda lõputult ja seda nimetatakse (looduses veetsükliks). Kui keegi ei hakka seda protsessi mõjutama kunstlike geotehniliste meetoditega ja atmosfääri kunstlikult muutma.
See külm kiht piirab veeauru difusiooni kõrgusele.
Veeauru difusioonikiht on pilvede tekkimise kõrgusel, 0,5-8 km kõrgusel. Seal asuvad kuulsad “pilved” ja seal on temperatuur vahemikus +10 kuni -30.
Atmosfääri miinustemperatuuriga kiht (- 56,5 °C) asub 11-20 kilomeetri kõrgusel. See piirab aurude levikut kõrgusel.
Siin kipuvad osa auru molekulidest, mille mass on 18,16 g/mol, koonduma suuremateks molekulideks ja langevad seejärel vihma või lumena maa peale tagasi. Seda teeb planeet juba miljoneid aastaid järjest oma õhuniiskust reguleerides.
Võtame sellise seisukoha nagu osoon, mis pseudokontseptsiooni ja pseudoteooria kohaselt mängib kõige olulisemat rolli planeedi kaitsmisel ülekuumenemise eest. Sellel kõrgusel (11-20 km) ka ei saa olla mingisugust oma osoonikihte.
31 kilomeetri kõrgusel lõhustab päikese ultraviolettkiirgus hapniku molekuli (O2) kaheks aatomiks (O+O). Neid kahte aatomit peetakse “ebastabiilseks” (ioonid), sest lõhustumisprotsessi käigus toimus lõhustumisreaktsioon koos soojuse eraldumisega. Nende kahest ebastabiilsest aatomist ühe neist liitmisel hapniku molekulile (O2) moodustub uus molekul, mida nimetatakse osooniks (O3), mille molekulkaal on 3×16 g/mol ja kogukaal 48 g/mol.
Maad ei kaitse mitte osoon, vaid hapnik, alates 31 km kõrguselt ja lõpetades ABS=0 kõrgusel. See protsess toimub kogu 31 km ulatuses.
Osooni kaal ületab süsinikdioksiidi (CO2 = 44,01 g/mol) kaalu koguni 9% võrra.
Kuna osoon liigub maapinnale, eraldub O3 molekulist kergesti ebastabiilne aatom, mis osaleb kõigi looduses esinevate keemiliste elementide oksüdatsiooniprotsessides. Osooni peetakse seetõttu väga tugevaks oksüdeerijaks. Osoon täidab siinkohal hapniku transportimise ja toimetamise rolli maapinnale. Seda rolli on osoon täitnud ja täidab juba miljoneid aastaid.
Mida veel selle teema kohta teada?
Seda, et CO2 ei saa hävitada osooni oma kergesti rändava “lisaatomiga”. Sest … CO2 ei ole põhikeemia järgi enam üldse oksüdeerunud! CO2 oksüdatsiooniaste on alati 0 !!!! Lugu CO2 osooni hävitamisest ei toeta keemiateadus. Sest nende vahel looduses ei ole üldse mingeid reaktsioone.
Lihtsa algkooli keemia aluste tundmisega saab hõlpsasti paljastada “Kyoto protokolli” ja “Pariisi lepinguga” seotud pettuse.
Teises osas kirjeldatakse, kuidas ja kes loob võltsinguid ja pseudoteooriaid.